
Termoquímica: É a parte da química que estuda as variações de energia que são produzidas em uma mudança química. De seu estudo, terminaremos sabendo se uma mudança química é espontânea ou não.
Cientistas importantes trabalharam em termoquímica
Embora o estudo de fenômenos térmico pode ser rastreada para os sábios gregos que descreve um aparelho em que o ar e os vapores foram comprimidas, que é tradicional para associar o início da termodinâmica com o primeiro termômetro, atribuída a Galileu.
Em 1641, o Duque da Toscana, fundador da Academia florentino das experiências, tomando vantagem de as, em seguida, – tubos capilares de vidro tecnologia emergentes, inserir o termômetro com álcool e vedação capilar, quase como os utilizados hoje em dia, e em que o tempo já ele começa a distinguir entre a temperatura (estado térmico) e calor (fluxo de energia térmica).
Na meados do século XVII, o Inglês cientista Robert Boyle encontrado que em gases fechados, à temperatura ambiente, o produto da pressão e volume permaneceu constante, e a temperatura de ebulição diminuiu com pressão.
Farenheit, um fabricante holandês de instrumentos técnicos, introduzido em 1717 como “pontos fixos” O congelamento de uma solução de água saturada de sal e a temperatura do corpo humano, dividindo-se em 96 partes iguais, esta escala que tem sido utilizado em Anglo – saxões até hoje (96 vindo de divisões sucessivas de 12 graus, usados na Itália no século XVII).
Em 1740, Celsius proposto pontos de fusão e ebulição da água ao nível do mar como pontos fixos e a divisão por 100 graus, embora atribuído 100 para o ponto de gelo e O a vapor (era o botânico e explorador Linnaeus depois a morte de Celsius, que mudou a ordem ‘).
No final do século XVII começou a usar vapor para mover as bombas de minas de carvão na Inglaterra. As primeiras máquinas foram bomba Savery (1698) e Newcomen (1711).
Durante o século XVIII, a base para o uso de motores a vapor resolvido para mover máquinas industriais e terra (locomotivas) transportes marítimos (barcos) e .Em 1769 Watt inventou a separação entre o expansor e do condensador e a partir de então ele começou a fabricar a nível industrial.
Importância da energia em reações químicas
O estudo da energia nas reações químicas é importante, pois, dependendo dos valores dessa energia, a reação será exotérmica ou endotérmica.
Reações exotérmicas: Eles liberam energia.
– Reações endotérmicas: A energia absorvida é a reação na direção oposta à exotérmica.
Também é importante estudar o calor (Q) e o trabalho (W), ambos estão relacionados à energia porque dependem da variação do mesmo.
-Calor: Mede a variação de energia quando a temperatura varia e / ou ocorre uma mudança de estado.
-Trabalho: Mede a variação da energia cinética y / o potencial. Para que haja trabalho, deve haver uma força resultante que produza um deslocamento.
Essas duas variações de energia estão relacionadas da seguinte maneira:
A variação interna de energia de um sistema é igual ao calor ganho pelo sistema mais o trabalho realizado pelo sistema. Tanto o calor quanto o trabalho feito pelo sistema são positivos, enquanto que o que contribuiu para o sistema é negativo.
Estudamos também a energia e sua relação com reações químicas no primeiro princípio da termodinâmica. “A energia não é criada nem destruída, apenas se transforma”.
Portanto, é analisar as variações de energia de uma reação para saber se é exotérmica, endotérmica e mais ou menos estável.
Conceitos básicos de termoquímica
A termoquímica é a parte da termodinâmica que lida com as trocas de energia em reações químicas. Embora também existam numerosos processos físicos envolvendo transferência de calor, como mudanças de fase e a formação de soluções.
Quando uma reação química ou processo físico libera calor, diz-se que é exotérmico. Um processo será endotérmico quando absorver calor. O termo usado para a grandeza de medição desta troca de energia é chamado de entalpia (calor a uma pressão constante), representada por Δ H
Vamos ver o exemplo da combustão de metano:
CH4+ 2 O2→ CO2+ 2 H2O Δ H= – 803k J/ moul
Esta reação libera 803 KJ / mol sob condições padrão a 25 ° C. Como é um calor separado (reação exotérmica), consideramos negativo, e é o calor emitido pela combustão de uma mole de metano a pressão constante, isto é, sua entalpia de combustão.
Em termos de termoquímica, se usam os seguintes conceitos:
– Sistema: parte do universo em estudo.
– Parte do universo que interage com o sistema.
– Sistema aberto: pode trocar matéria e energia com o meio ambiente.
– Sistema fechado: pode trocar energia, mas não importa, com o meio ambiente.
– Sistema isolado: não troca matéria ou energia.
As paredes do sistema (separação entre sistema e ambiente) podem ser:
– Permeável: permitir a passagem da matéria
– Impermeável: não permita a passagem da matéria.
– Condutores ou diatérmicos: permitem a passagem de energia.
– Isolante ou adiabático: eles não permitem a passagem de energia.
Os processos termodinâmicos podem ser classificados nos seguintes tipos:
– Processos isobáricos: ocorrem a pressão constante.
– Processos isotérmicos: ocorrem a uma temperatura constante
– Processos isocóricos: eles ocorrem em volume constante.
– Processos adiabáticos: ocorrem sem transferência de calor entre o sistema e o ambiente.
O Calor: Conceito fundamental da Termoquímica
O calor é uma forma de troca de energia entre o sistema e seus arredores devido a uma diferença de temperatura. Os sistemas termodinâmicos não têm calor, eles têm energia e uma das maneiras pelas quais essa energia se intercala é o calor.
O calor flui sempre do corpo de temperatura mais alta para a temperatura mais baixa, até atingir o equilíbrio térmico, quando as temperaturas de ambos os corpos são equalizadas.
A transferência de calor pode não apenas causar mudanças na temperatura, mas também pode levar a mudanças no estado de agregação da matéria, fusão de sólidos, vaporização de líquidos … Durante essas mudanças de fase, a temperatura permanece constante, usando o energia térmica na superação das forças de interação entre as moléculas que compõem o sólido, no caso da fusão. Na vaporização, a energia térmica é usada para superar as forças entre as moléculas líquidas e permitir que elas passem para a fase de vapor.
A quantidade de calor que deve ser fornecida a uma substância para modificar sua temperatura dependerá de:
– A mudança de temperatura que a substância sofre.
– a massa da substância
– O tipo de substância
Tomando estes três fatores em consideração, podemos formular a seguinte equação:
q= m ceΔ T
Sendo:
q : quantidade de calor necessária para elevar a temperatura corporal por Δ T
m : massa corporal.
ce : calor específico do corpo.
Δ T : mudança de temperatura.
Vamos ver um exemplo:
Quanto calor é necessário para elevar a temperatura de 100 g de água de 20 para 80 ° C? O calor específico da água é de 4,18 J / gºC.
Nós aplicamos a equação .q= m ceΔ T
Onde:
m = 100g
ce= 4,18J/ gº C
Δ T= 80 – 20 = 60º C
q= 100g⋅ 4,18J/ gº C⋅ 60 º C= 25080J
Critério de sinais:
Na equação, quando um aumento da temperatura ocorre no corpo , então quecalor trocadas tem um sinal positivo , é um calor que entra no sistema por aumentar sua temperatura q= m ceΔ TΔ T> 0q> 0
No caso de haver uma diminuição na temperatura do sistema e , nesse caso o calor deixa o sistema para o ambiente.Δ T< 0q< 0
Resumindo:
q> 0 , se o calor for do sistema para o ambiente (calor absorvido pelo sistema).
q< 0 , se o calor vai do ambiente para o sistema (calor dado pelo sistema)
Outro conceito de grande importância é a lei da conservação de energia . Nas interações entre o sistema e o meio ambiente, a energia é conservada. A energia que o sistema dá ao ambiente absorve e vice-versa. Esta lei de conservação de energia pode ser expressa na forma de calor trocado entre sistema e ambiente
Relação entre termoquímica e economia
Podemos relacionar a termoquímica com outros aspectos interessantes do dia a dia, neste caso faremos com a economia.
Antes de mais nada, devemos ter clareza sobre o conceito de economia: Ciência que estuda a produção e administração de bens e serviços.
Neste caso, em vez de bens e serviços, temos produtos e reagentes de uma reação química, contando também com energia.
Em termos de produtividade, em termos econômicos estamos sempre procurando maneiras de produzir mais, a um preço mais barato, para obter mais benefícios. Portanto, no nosso caso, precisaremos de uma reação que seja realizada com um nível mínimo de energia ou, como alternativa, escolheremos a reação que usa menos energia de ativação, já que será mais lucrativa. Falamos dessa maneira de procurar reagentes mais baratos e, com aqueles com menor quantidade, podemos obter mais produto.
Encontramos também uma relação com o 2º Princípio da Termodinâmica que estabelece uma importante limitação para qualquer transformação que utilize calor, trabalho ou energia útil e que os processos econômicos usem esses caracteres, ou seja, os processos econômicos têm limitações porque a produção é uma redução de energia e um aumento na entropia do universo. Mas, mesmo assim, as leis da economia sustentam que, uma vez atingido o equilíbrio de mercado, ele é estável e permanente quando, na realidade, a entropia tende a aumentar, isto é, não é estável.
Isso leva a um grande problema econômico, que se reflete no presente, um exemplo claro é a crise econômica pela qual estamos passando. Mas, apesar de saber que a economia não é estável e de que um sistema sempre tenderá ao caos, é difícil resolvê-lo porque os grandes produtores não estão interessados em mudar seu sistema produtivo e devido a certas restrições impostas pela economia. governos, já que a produção econômica não afeta apenas o dinheiro, também está afetando o meio ambiente, sobre o qual falaremos mais adiante.
Relação entre termoquímica e meio ambiente.
Para ver essa relação, precisamos primeiro saber o que é o ambiente. Chama-se ambiente, ambiente ou ambiente a tudo o que não está no sistema, mas que pode influenciá-lo. Por exemplo, considere uma xícara com água, que está sendo aquecida por um isqueiro, o sistema seria o copo com água, então o ambiente seria formado pelo ar, o isqueiro, etc.
Um exemplo claro desse relacionamento em todo o mundo é a famosa “mudança climática”, o aquecimento global de que todos falam em nossos dias e do qual vivemos suas consequências.
A temperatura do ambiente varia devido a mudanças químicas na atmosfera, pois há um aumento nos gases de efeito estufa que quebram a camada de ozônio, o que significa que os raios nocivos do sol alcançam a superfície da Terra mais facilmente. O que gera um aumento na temperatura. Isso causa, por exemplo, doenças de pele. Que no final do dia, são reações químicas. Mas seus efeitos não apenas prejudicam os humanos, mas todo o conjunto de seres vivos e inertes no planeta.
O CO2 é um dos principais gases de efeito estufa, por isso o corte de árvores contribui para o perigo das mudanças climáticas, mas isso também gera uma mudança ambiental, destruindo os ecossistemas de muitas espécies e que às vezes leva à extinção de certos animais e plantas.
Como pode ser visto, a termodinâmica tem um relacionamento direto com ambiente nada, desde que a temperatura é sempre presente, quer diretamente na temperatura do corpo animal e vegetal como seres inertes indiretamente pela temperatura do seu ambiente. Apesar de ser inerte a temperatura os influencia, um exemplo claro é a água, que em baixas temperaturas congela formando gelo enquanto a temperaturas de 100 ° C ou mais evapora.
A temperatura também influencia o clima, que, como já mencionamos, está atualmente mudando devido ao aquecimento global.
Nas grandes cidades, o nível de poluição observado no ambiente é bastante considerável, existem variações na temperatura e na entropia, portanto a termoquímica também influencia esse fator. Tanta poluição ambiental é devida tanto ao lixo que você expulsa indústrias quanto a automóveis. Nos motores de combustão interna de automóveis, utiliza-se a energia derivada da combustão da gasolina. Quando o combustível dentro do cilindro é queimado, o gás formado gera o movimento do pistão cujo movimento serve para mover as rodas do carro. Mas infelizmente neste processo muita da energia é desperdiçada, apenas 20% se torna um trabalho útil.
Por estas razões que é importante estudar a termoquímica relação ao meio ambiente, a cada dia que passa nós poluir mais e mais até que ele atinja um ponto onde as catástrofes são tais que não podemos fazer nada sobre isso.
Reações exotérmicas e endotérmicas

Reações em que um combustível combina com o oxigênio para produzir água e dióxido de carbono são chamadas de reações de combustão. Como o gás natural consiste principalmente de metano, espera-se que a reação (representada acima) libere o calor. Reações que liberam o calor são denominadas reações exotérmicas, e reações que absorvem calor são denominadas reações endotérmicas.
O calor associado a uma reação química depende da pressão e temperatura em que a reação é realizada. A quantidade de calor liberada em uma reação depende da quantidade de material que sofre reação.
As fórmulas químicas que aparecem em uma reação representam, cada uma, um mol do material; por exemplo, o símbolo CH 4 representa um mol de metano com uma massa de 16 gramas, e o 2 O 2 (g) indica que são necessários dois mols de oxigênio. A termoquímica também depende do estado físico dos reagentes e produtos. Por exemplo, o calor liberado na equação mencionada acima é de 890 quilojoules (kJ); Se, no entanto, for formada água na fase gasosa, H 2 O (g), o calor liberado é de apenas 802 kJ. Invertendo uma reação como na usada de exemplo, que libera o calor, é produzida uma reação em que o calor deve ser fornecido para que a reação ocorra.
Entre as reações da termoquímica, está a Entalpia. Ela é resultado da energia trocada nas reações de absorção e de liberação de energia – endotérmica e exotérmica, respectivamente. Não tem como medir a entalpia, mas sim a sua variação. Isso é feito considerando a entalpia do reagente e a entalpia do produto. Essa variação foi desenvolvida através da Lei de Hess.
Lei de Hess
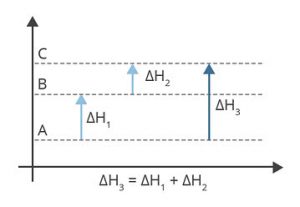
A lei de Hess afirma que a mudança de entalpia na conversão de reagentes em produtos é a mesma, independentemente da rota adotada.
Assim, a mudança de entalpia para duas rotas dos mesmos reagentes para os mesmos produtos será igual.
