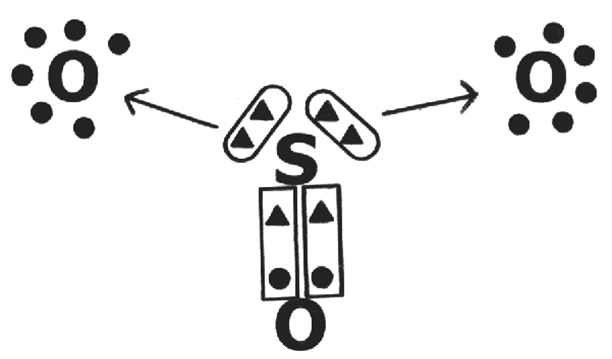
Existem diferentes tipos de ligações químicas. São eles: ligação iônica, ligação covalente, ligação covalente dativa e ligação metálica. Muitas dessas ligações, em suas aplicações, trabalham em volta da teoria do octeto, que prega diz que um átomo adquire estabilidade ao possuir oito elétrons em sua camada de valência – ou dois elétrons se ele possuir apenas uma camada.
Agora, vamos conhecer um pouco mais sobre as ligações covalentes.
O que é ligação covalente?
 ligação-covalente-dupla
ligação-covalente-dupla
Uma ligação covalente é uma ligação química entre dois átomos ou íons, onde os pares de elétrons são compartilhados entre eles. Uma ligação covalente pode também ser denominada uma ligação molecular. As ligações covalentes formam-se entre dois átomos não metálicos com valores de eletronegatividade idênticos ou próximos. Esse tipo de ligação também pode ser encontrado em outras espécies químicas, como radicais e macromoléculas. O termo “ligação covalente” entrou em vigor pela primeira vez em 1939, embora Irving Langmuir tenha introduzido o termo “covalência” em 1919 para descrever o número de pares de elétrons compartilhados por átomos vizinhos.
Os pares de elétrons que participam de uma ligação covalente são chamados de pares de ligação ou pares compartilhados. Tipicamente, o compartilhamento de pares de ligação permite que cada átomo atinja um escudo de elétrons externo estável, semelhante ao observado em átomos de gás nobre.
Ligações covalentes polares e não polares
Dois tipos importantes de ligações covalentes são ligações covalentes não polares ou puras e ligações covalentes polares. Ligações não polares ocorrem quando os átomos compartilham igualmente pares de elétrons. Uma vez que apenas átomos idênticos (mesma eletronegatividade) realmente se envolvem em compartilhamento igual, a definição é expandida para incluir ligação covalente entre quaisquer átomos com uma diferença de eletronegatividade menor que 0,4. Exemplos de moléculas com ligações não polares são H2, N2 e CH4.
À medida que a diferença de eletronegatividade aumenta, o par de elétrons na ligação está mais intimamente associado a um núcleo do que ao outro. Se a diferença de eletronegatividade estiver entre 0,4 e 1,7, a ligação é polar. Se a diferença de eletronegatividade for maior que 1,7, a ligação é iônica.
Exemplos de ligação covalente
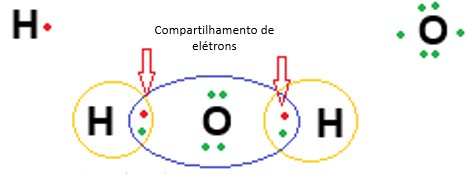
 Existe uma ligação covalente entre o oxigênio e cada hidrogênio em uma molécula de água (H2O). Cada uma das ligações covalentes contém dois elétrons – um de um átomo de hidrogênio e outro do átomo de oxigênio. Ambos os átomos compartilham os elétrons.
Existe uma ligação covalente entre o oxigênio e cada hidrogênio em uma molécula de água (H2O). Cada uma das ligações covalentes contém dois elétrons – um de um átomo de hidrogênio e outro do átomo de oxigênio. Ambos os átomos compartilham os elétrons.
Uma molécula de hidrogênio, H2, consiste de dois átomos de hidrogênio unidos por uma ligação covalente. Cada átomo de hidrogênio precisa de dois elétrons para atingir um escudo de elétrons externo estável. O par de elétrons é atraído pela carga positiva de ambos os núcleos atômicos, mantendo a molécula unida.
O fósforo pode formar PCl 3 ou PCl 5. Em ambos os casos, os átomos de fósforo e cloro estão ligados por ligações covalentes. PCl 3 assume a estrutura de gás nobre esperada, onde os átomos atingem as camadas externas de elétrons. No entanto, PCl 5 também é estável, por isso é importante lembrar que as ligações covalentes nem sempre obedecem à regra do octeto.
