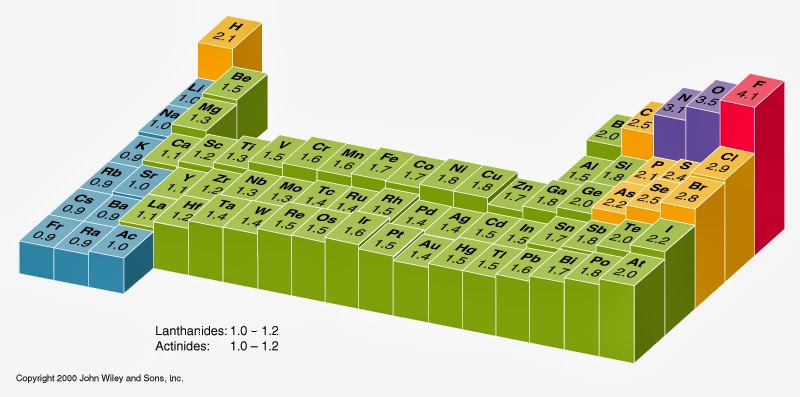
A eletronegatividade é uma medida da tendência de um átomo de atrair um par de elétrons de ligação.
A escala de Pauling é a mais usada para estabelecer os valores de eletronegatividade. Ao flúor (o elemento mais eletronegativo) é atribuído a um valor de 4,0, e os valores variam até os elementos césio e frâncio, que são os menos eletronegativos em 0,7.

Quando dois átomos de eletronegatividade igual se encontram eles criam uma ligação que une os pares de elétrons na metade da distância entre eles, pois tem a mesma tendência de atração.
Quando um átomo é ligeiramente mais eletronegativo que o outro, o que tem maior valor de eletronegatividade irá atrair os pares de elétrons para mais próximo de si na ligação estabelecida.
Isso significa que o fim do vínculo mais próximo ao átomo de maior eletronegatividade terá mais do que a metade de densidade de elétrons e, portanto, torna-se ligeiramente negativo. Ao mesmo tempo, o final mais próximo ao outro átomose torna ligeiramente positivo.
Isso é descrito como uma ligação polar. Uma ligação polar é uma ligação covalente na qual há uma separação de carga entre uma extremidade e a outra – em outras palavras, em que uma extremidade é ligeiramente positiva e a outra ligeiramente negativa. Exemplos incluem a maioria das ligações covalentes. A ligação hidrogênio-cloro no HCl ou as ligações hidrogênio-oxigênio na água são exemplos típicos.
Mas o que acontece se um átomo é muito mais eletronegativo que outro?
Nesse caso, o par de elétrons é arrastado para a extremidade do vínculo do átomo mais eletronegativo. Para todos os efeitos e propósitos, o átomo menos eletronegativo perdeu o controle de seu elétron, e o mais eletronegativo tem controle completo sobre ambos os elétrons. Nessa situação, íons foram formados, configurando uma ligação iônica.
– Estabelecendo os padrões de eletronegatividade na tabela periódica
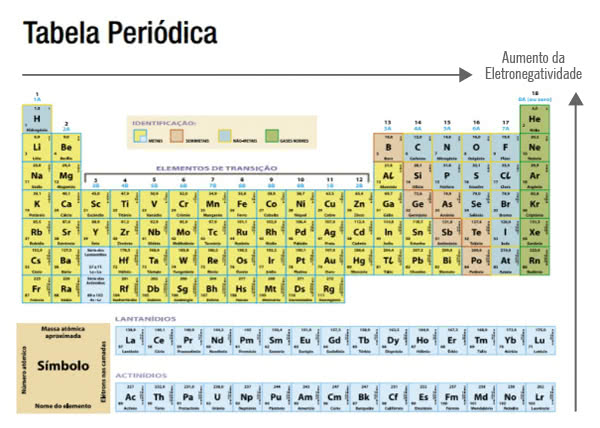 eletronegatividade – como funciona
eletronegatividade – como funciona
O elemento mais eletronegativo é o flúor. Se você se lembra desse fato, tudo fica fácil, porque a eletronegatividade sempre deve aumentar no sentido do flúor na Tabela Periódica, ou seja, aumentando da esquerda para a direita e da base para o topo.
– Entendo os padrões em eletronegatividade
A atração que um par de elétrons de ligação sente por um núcleo particular depende de:
